Металлический узор часть 1 – самый легкий
Предыдущая статья заканчивалась превью опыта работы с литиевыми элементами, получившего в прошлом году Нобелевскую премию по химии. Сериал из трех последовательных серий, который начинается с презентации лития, станет своеобразным продолжением сериала о галогенах, завершившегося в декабре. Элементы 17-й группы являются модельными неметаллами, а литии – эталоном металличности.
Читатели, знакомые с физическими свойствами литиевые металлыможет удивиться такому заявлению. Вещества, обычно плавящиеся при температуре не выше 100°С, мягкие настолько, что их можно резать ножом и, кроме того, быстро реагирующие с кислородом и водой, должны ли они быть эталонами металлов? И что из них можно построить?
Литиевые сплавы действительно не подходят для конструкционного материала, но это не меняет того факта, что они являются полноценными металлами. Причина несовпадения – разное понимание этого понятия бытовым и научным языком. Поэтому не всякий металл является твердым и негорючим веществом — пример ртуть.
Легкий вес корня…
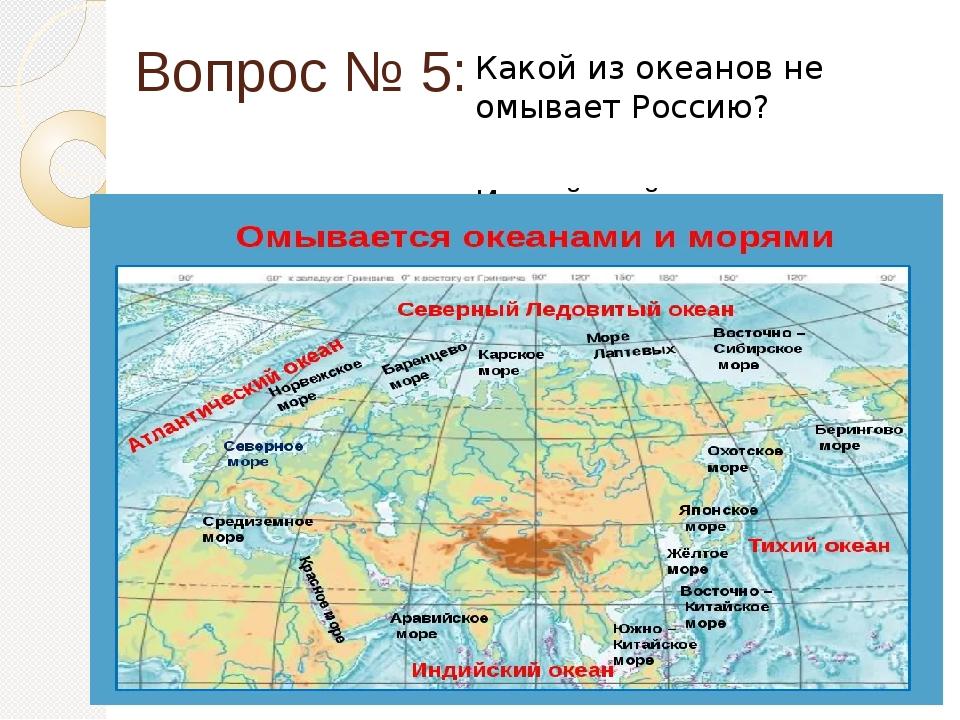
После газообразного водорода и гелия в таблице Менделеева появляется первый металл — литий. Все семейство получило свое название от его имени (водорода, хотя он тоже принадлежит к группе 1, было в нем немного по необходимости – надо было просто куда-то положить этот другой элемент). Возвращаясь к литию, название не случайно для вещества, имеющего плотность 0,54 г/см3это то же самое, что сосновый лес.
Кусочек лития плавает в воде, но недолго, потому что быстро с ней реагирует. По обеим этим причинам его хранят в застывшем парафине, так как он вытекает на поверхность керосина, используемого для защиты остальных щелочных металлов от кислорода и влаги. Литий плавится примерно при 180°С (самая высокая из всех щелочных металлов), но кипит почти на 1200° выше. Такую большую разницу редко увидишь. Кроме того, это металл серебристо-серого цвета, который можно резать ножом, но площадь поперечного сечения быстро темнеет (хотя и медленнее, чем у других элементов этой группы) (1).
В 1800 году на шведском острове был обнаружен минерал, названный его именем. лепестокно только семнадцать лет спустя был исследован его химический состав. Молодой человек взялся за дело Иоганн Август Арфведсон, 25-летняя ученица знаменитого Берцелиуса (которым мы обязаны, в том числе, используемым в настоящее время обозначениям элементов). Арфведсон пришел к выводу, что минерал принадлежит к группе алюмосиликатов, большому семейству соединений, состоящих из алюминия, кремния и кислорода, сопровождаемых металлом — обычно натрием, калием или кальцием. Хотя анализы показали наличие в петалите металла, подобного натрию, его масса не соответствовала. Она была примерно в три раза меньше, чем должна была бы быть, если бы натрий действительно входил в состав минерала (атомная масса натрия — 23 единицы, лития — 7 единиц).
Берцелиус, бесспорный авторитет того времени, заявил, что был открыт новый элемент, который он назвал в честь греческого слова lithos, означающего камень (2). Подчеркивалось, что хотя освещенный он подобен уже известным натрию и калию, выделен из минералов, а не из растительных и животных веществ (однако это тоже микроэлемент, присутствующий в метаболических путях живых организмов). Арфведсон также нашел новый металл в ряде других минералов, что подтвердило правильность названия. Можно было выделить только чистый металлический литий (электролизом его хлорида). Роберт Бунзен i Аугустусови Маттиессенови, в 1855 г. Имя первого связано с историей открытия двух других литиев.
2. Важные фигуры в истории лития. Слева: его первооткрыватель Йохан Август Арфведсон (1792-1841). Справа: Йенс Якоб Берцелиус (1779–1848).
Сколько лития на Земле? Довольно много, около 0,0065% от массы поверхности слоя, что делает его 26-м по содержанию элементов. Хотя процент не кажется особенно высоким, лития почти столько же, сколько азота, и больше, чем цинка и олова. А во Вселенной? Литий образовался вскоре после Большого взрыва вместе с водородом, гелием, бериллием и бором и до сих пор вырабатывается в звездах. Однако он довольно легко реагирует с протонами, поэтому в космосе есть только следы лития.
… для тяжелой работы
Несмотря на свою филигранную массу, литий не чурается работы. Среди соединений этого элемента в массе наибольшую долю имеет использование оксида и карбоната лития в качестве компонентов жаростойких стекол и покрытий для керамики. Следующим является использование лития для создания источников энергии. Это относительно новое применение, но широко представленное в современном мире: от небольших литиевых элементов до питания часов или электронных систем компьютеров, через аккумуляторы для мобильных телефонов, ноутбуков и электроинструментов, и заканчивая батареями в электромобилях, например, в электромобилях. знаменитый Tesla Roadster (3).
3. Перезаряжаемый литий-ионный аккумулятор. В прошлом году Нобелевская премия по химии была присуждена за работы по его строительству.
и – благодаря малому весу металла – аккумулируют гораздо больше энергии на единицу массы, чем в случае конструкций на основе других элементов. Соли лития и жирных кислот (литиевые мыла, например, стеарат лития) являются ценным компонентом смазочных материалов, работающих в широком диапазоне температур (включая отрицательные температуры). Карбонат лития — старейший препарат, применяемый на сегодняшний день при лечении психических расстройств, стабилизирующий работу нервной системы.
Металлический литий впервые был использован в качестве добавки, повышающей прочность алюминиевых, свинцовых и магниевых сплавов. Литий легко соединяется с водородом, образуя гидрид. Поскольку это соединение выделяет водород при взаимодействии с водой, его можно использовать в качестве хранилища водорода. Во время последней войны гидрид лития использовался для быстрого наполнения спасательных жилетов. Изотоп лития-6 при бомбардировке нейтронами создает попробовать (водород-3), необходимый для синтеза термоядер.
Под воздействием миллионов градусов температуры и огромного давления тритий соединяется с дейтерием (водородом-2), выделяя огромное количество энергии. До сих пор этот процесс удавалось осуществить только бесконтрольно, при взрыве термоядерной бомбы (детонатором, поставляющим нейтроны и создающим соответствующие условия реакции, был взрыв обычной атомной бомбы) (4).
4. Сила дейтерида лития – взрыв термоядерной бомбы Castle Bravo на атолле Бикини в 1954 году.
Литий под рукой
В отличие от других металлов лития, металлический литий действительно у вас под рукой. Вашим источником будет литиевая батарея. Аккумуляторы не берите только для питания телефона или ноутбука, ведь их разборка опасна (не забудьте сдать бывшую в употреблении технику в пункт приема). Для проведения экспериментов вам нужна только ссылка с пометкой CR2032. Он часто используется для питания определенных типов калькуляторов и чипов материнской платы компьютера.
5. Слева — элемент CR2032 с последующими результатами его «разреза»: корпус со слоем металлического лития; сепаратор, пропитанный неводным электролитом; пластиковое кольцо (изоляция); слой диоксида марганца; вторая часть корпуса.
6. Литий в пламени горелки.
Сожмите плоскогубцами звено (оно развалится) и разложите фрагменты конструкции на подносе. Ячейка состоит из металлических частей, образующих корпус, черный спрессованный слой, содержащий диоксид марганца MnO.2, пористый сепаратор, пропитанный безводным органическим электролитом, и изолирующее пластиковое кольцо (5). Литий нанесен на меньшую часть корпуса (отрицательный электрод), его можно разрезать ножом и увидеть, что он темнеет на воздухе. Используйте конец железной проволоки, чтобы взять немного мягкого металла и вставьте образец в пламя горелки – он превратится в кармин (6). Цвет также характерен для соединений лития. Вы заметите похожий цвет, если добавите в пламя горелки соли стронция группы 2.
Поместите корпус с остальным металлом в стакан с небольшим количеством воды. Реакция растворения лития протекает в сосуде:
Универсальная бумага, погруженная в полученный раствор, окрашивается в синий цвет, что доказывает, что гидроксид лития является сильным основанием (7). Не выливайте раствор — следующий опыт вы проведете с ним через минуту.
7. Слева: растворение лития в воде (на дне стакана виден фрагмент корпуса кюветы). Справа: синий цвет индикаторной бумаги показывает, что полученный раствор гидроксида лития является щелочным.
Протей
Первооткрыватель уже заметил, что литий похож на остальные элементы группы 1. Однако литий ведет себя немного иначе, чем его собратья с большей массой.
Полученный ранее раствор залить в испаритель и осторожно выпарить. После остывания залить осадок как можно меньшим количеством 5—10%-ного раствора соляной кислоты и снова выпарить воду. Вы получите хлорид лития LiCl.
Растворите часть соли в небольшом количестве воды и перелейте раствор в пробирку. Добавьте раствор карбоната натрия Na2CO3. В сосуде должен образоваться белый осадок, и если вы ничего подобного не заметили, подогрейте пробирку. Карбонат лития Li2CO3 он мало растворим в воде, кроме того, его растворимость уменьшается с повышением температуры. Это необычный случай: растворимость большинства соединений увеличивается при нагревании раствора, а соли элементов 1 группы, в том числе и карбонаты, хорошо растворимы. Осадок также образуется при обработке раствора хлорида лития раствором фосфата или фторида натрия.
Результаты реакции показывают, что литий не является обычным металлическим литием. Его свойства несколько схожи со второй группой соседей, особенно с магнием.
Попробуйте провести аналогичные тесты с с магнием: добавьте любой растворимый раствор карбоната, фосфата или фторида в раствор соли этого элемента (наиболее доступны хлорид или сульфат). В любом случае вы получите белые отложения. Вы помните обнаружение углекислого газа с помощью известковой воды? Там тоже происходит осаждение карбоната. Но не думайте, что литий находится не на том месте в таблице Менделеева. Это одновалентный элемент, и определенная обособленность лидера группы от других членов семьи является правилом в таблице Менделеева (см. рамку: Кузены по диагонали).
Больше лития в месяц, не отличается от нормы 1 группы.
Смотрите также: