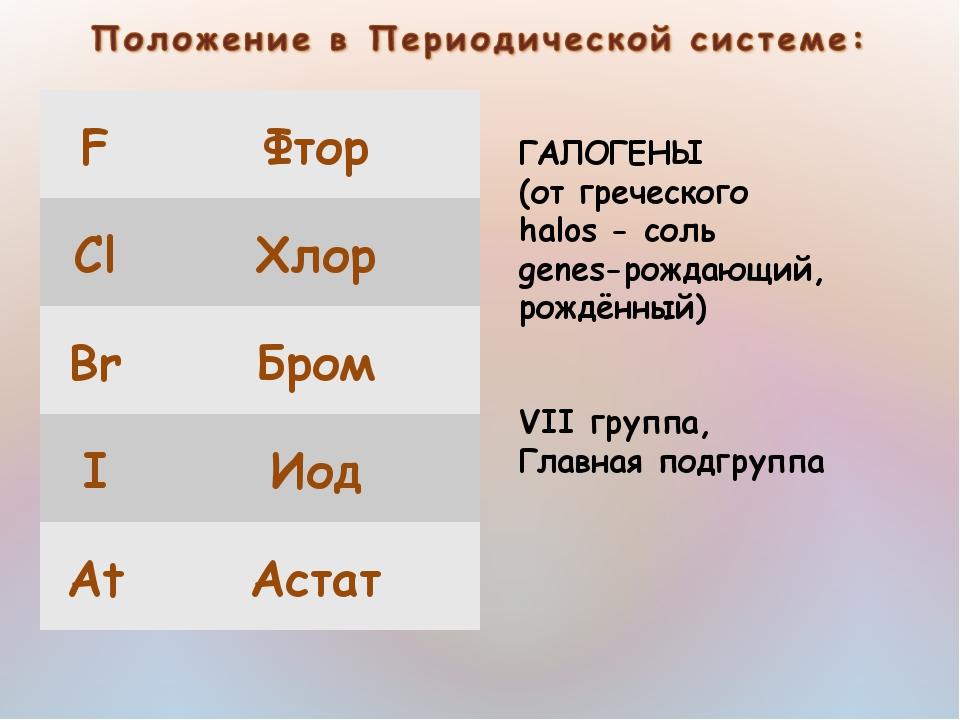
Те, что образуют соли — Галогены и фтор
Почти в самом конце таблицы Менделеева поселилось семейство неметаллов. Химически активные, они энергично атакуют другие вещества, а соединяющиеся с ними элементы обычно отнимают электроны. Впереди нас группа из 17 человек.
Галогены являются не только ярким примером неметаллических элементов. В этой группе, как и в любой другой группе, представители различаются по физическому состоянию и окраске. С другой стороны, изменения химической активности удивительно регулярны. Все они похожи, но у каждого свой характер.
Семейный портрет
Предположим, что они есть. В таблице Менделеева их шесть, но в действительности вы будете экспериментировать только с первыми четырьмя. Однако не расстраивайтесь — у вас также нет шансов столкнуться с самыми тяжелыми элементами группы 17 (см. врезку «Отсутствующие галогены»).
Не хватает галогенов…
… Есть астат А и теннессин Ц. Последний был произведен в 2010 году в российской ядерной лаборатории в Дубне. Международная команда физиков получила целых шесть ядер (!) нового элемента, которые, однако, жили доли секунды. Название было дано в честь штата Теннесси, где находится известная ядерная лаборатория Ок-Ридж (оттуда пришел изотоп берклий — сырье для получения элемента 117).
Астатус встречается на Земле как компонент радиоактивного ряда, но природные изотопы образуются в боковых ветвях ряда и весьма неустойчивы (от греч. астатос = неустойчивый). Подсчитано, что на данный момент в земной коре находится не более грамма астатуса! Для исследовательских целей производятся изотопы с более длительным сроком жизни (исчисляемым часами). Впервые астат искусственно сохранили в 1940 году, и только потом было обнаружено, что он присутствует в природе.
Фтор при комнатной температуре и нормальном давлении это желто-зеленый газ. это тоже газ, но с более зеленым оттенком. Бром это коричнево-красная жидкость, образующая сине-черные кристаллы, которые легко возгоняются в виде пурпурных паров.
Астату i Tennessine никто не видел (и не ожидается, что будут получены различимые образцы). Данные о температурах плавления и кипения первых четырех галогенов можно найти в таблице в конце статьи — на их основе попробуйте оценить соответствующие значения для астатуса и теннессина (об этом также говорят авторы учебники делают) (1).
1. Галогены — фторид в ампуле под высоким давлением для лучшей визуализации его цвета; газообразный хлор расположен над сжиженным (фото с сайта http://images-of-elements.com).
На поверхности довольно много первых двух галогенов. По своему распространению хлор занимает одиннадцатое место (ок. 0,1% массы земной коры, воды и атмосферы), а фтор шестнадцатое (ок. 0,03%).
Бром i йод микроэлементы, занимающие места 54 (около 0,0002%) и 65 (около 0,00005%) соответственно. Основным растворенным в морской воде ингредиентом является хлорид натрия, также в ней много хлорида магния. На втором месте бром, затем фтор, и снова замыкает ряды йод. Объяснением такого порядка является плохая растворимость фторсодержащих минералов.
Флуоровце они не свободны от природы, они слишком реактивны для этого. В основном вы встретите их (F-, Cl-, Br- и I-; когда речь идет о галогене вообще, используется символ X, поэтому анион X-), и в этой форме они также входят в состав минералы.
Название флюорес обозначает все элементы в группе 17. Первые четыре в разговорной речи галогены, то есть титул «солеобразующий» (греч. = соль, = творю). В дополнение к этим названиям также используется термин галогены (хлор, бром и йод). Причина в свойствах фтора, которые незначительно отличаются от свойств других представителей группы. Однако это не аномалия, а закономерность в таблице Менделеева — точно так же другие ведущие элементы «выделяются» из остального своего семейства. Галогены образуют кислоты с общей формулой НХ (при этом HF относительно слабая, остальные сильные), а галогены также кислоты с кислородом. В свободном состоянии галогены существуют в виде двухатомных молекул X.2.
Вот вам и обычный портрет. Пришло время презентаций отдельных членов семьи.
Самый агрессивный
С пятнадцатого века его применяли в металлургии, который при добавлении в руду снижал температуру ее плавки. Его назвали флюоритом, от латинского fluere, что означает «течь». В конце XNUMX века плавиковый шпат был исследован более тщательно, и было обнаружено, что он состоит из кальциевой земли (которую тогда называли CaO) и кислоты, способной травить стекло. По представлениям того времени считалось, что эта кислота должна содержаться, но обнаружить ее не удавалось.
В начале 75 века было признано его существование и элемент, входящий в состав HF, был назван фтором (от минерала). Попытки изолировать его как личность не увенчались успехом в течение следующих 1886 лет. Так было до тех пор, пока французский химик Анри Муассан не сделал это в 2 году путем электролиза фторида калия в безводном фтористом водороде (сегодня электролиз расплавленной соли является наиболее распространенным методом), за что двадцать лет спустя он был удостоен Нобелевской премии (XNUMX).
2. Анри Муассан (1852-1907) и эскиз аппарата для получения фтора из работы первооткрывателя. Сам Муассан утверждал, что фторид сократил его жизнь на десять лет.
Свободный фтор — наиболее активный неметалл, бурно реагирующий почти со всеми элементами (сопротивляется только самый легкий гелий). Его агрессивность вызывает проблемы при транспортировке, поэтому его перевозят в медных или железных баллонах, поверхности которых покрыты слоями нерастворимых фторидов этих металлов. Наиболее важными фторидными минералами являются флюорит (фторид кальция CaF2) (3) и криолит (гексафторалюминат натрия Na3АльФ6), используемые в качестве флюсов. Другим минералом, содержащим фторид, является апатит, основная руда фосфора.
Фтор служит окислителем в ракетных топливах и для синтеза фторированных углеводородов и летучего фторида урана (позволяет разделять изотопы этого металла для военных и атомно-энергетических целей).
Среди популярных соединений фтора нужно также упомянуть вредный для здоровья фтористый водород, используемый для травления стекла (растворяет кремнезем), и фтористый натрий, входящий в состав зубных паст. Ионы фтора встраиваются в эмаль, создавая кислотоустойчивый фторапатит — только помните, что нельзя передозировать препараты фтора, потому что в более высоких дозах они токсичны (разрушают кости).
Фтор он также образует ряд очень важных органических соединений, например, тефлон и фреоны. Последние являются производными углеводородов хлора и фтора, вызывающих много споров на протяжении многих лет. До недавнего времени они обычно использовались в качестве хладагента в холодильниках и кондиционерах, а также в качестве газа-носителя в контейнерах под давлением (например, в дезодорантах). В настоящее время фреоны исключены из многих старых применений, и причина, как ни парадоксально, в их крайне низкой реакционной способности. Благодаря этому большая часть продукции до сих пор находится в атмосфере Земли. Они нетоксичны, но их обвиняют в разрушении озонового слоя.
враг стекла
Теперь вам понадобится фторид натрия, NaF и концентрированный раствор серной кислоты (VI) H.2SO4.
На кусок обычного оконного стекла насыпьте небольшое количество NaF и смочите кристаллы раствором кислоты. Проведите эксперимент на улице или в вытяжном шкафу — он выделяет вредный фтористый водород. Примерно через час вымойте стекло (необходимы резиновые перчатки — вы имеете дело с H2SO4) и осмотрите его поверхность. Вы заметите признаки повреждения, вызванного действием соединений фтора. На первой стадии довольно слабая плавиковая кислота вытесняется из ее солей более сильной кислотой:
2NaF+H2SO4 → 2HF + Na2SO4 →
Затем HF реагирует с кремнеземом в стекле:
SiO2+4HF → SiF4 ↑ + 2H2O
Этот простой в выполнении тест используется в химическом анализе для обнаружения фторидов (ни один другой анион не дает такого результата теста) (4).
4. Травление стекла фтористым водородом: смочить наносимую на стекло порцию NaF концентрированной серной кислотой и через некоторое время промыть поверхность (в защитных перчатках!). Метка на стекле показывает наличие фтора в образце.
С железом
Фторид-анион F- легко соединяется с катионом железа (III) Fe.3+ в комплексный ион с формулой FeF63-. Для эксперимента, доказывающего это, вам понадобятся: фторид натрия, NaF, и хлорид железа (III), FeCl.3.
В пробирку налейте небольшое количество раствора фторида натрия. Эффект виден сразу: желтоватая окраска тускнеет, а содержимое сосуда становится прозрачным (может появиться легкое белое помутнение, так как образовавшийся Na3FeF6 мало растворим) (5).
5. Гидратированный ион железа (III) имеет желтый цвет, а комплекс фтора бесцветный.
Сродство фторид-аниона к железу (III) настолько велико, что он может разлагать другие соединения этого металла, чтобы соединиться с ним. Если у вас есть KSCN калий-родий, вы можете сами убедиться в этой способности аниона F-. В пробирку с желтоватым раствором FeCl.3 влить немного бесцветного раствора родия. Содержимое приобретает кроваво-красный цвет. Однако при добавлении раствора фторида натрия «химическая кровь» (соединение используется как имитация настоящей крови, например, в пленках) исчезает, и раствор становится прозрачным. Вы наблюдали разложение родатного комплекса и образование фтора, на что указывают изменения цвета.
Химическая аналитика часто использует ваши испытания. Один из случаев – обнаружение ионов Cu2+ в присутствии Fe3+ (часто встречаются вместе в одном растворе, например, при тестировании медных руд). Делайте растворы CuSO4 ораз FeCl3. Вам также понадобятся: NaF и K.4[Fe (CN)6], то есть гексацианоферрат (II) калия (в просторечии ферроцианид калия; образует бледно-желтые кристаллы). Последнее соединение является чувствительным реагентом для обнаружения как меди, с которой он дает красно-коричневый осадок, так и железа (III) — при этом образуется темно-синяя окраска, так наз. Берлинская лазурь (выполните оба теста, чтобы увидеть цвета образовавшихся соединений) (6). Однако это не удается со смесью катионов.
6. Ферроцианидные комплексы меди (II) и железа (III).
Смешать (III) в двух пробирках — получатся зелено-желтые жидкости. После добавления в первую пробирку раствора ферроцианида калия появится темная окраска, по которой нельзя определить присутствие ионов Cu.2+ (7).
7. Слева: раствор солей меди и железа. Справа: пробирка после добавления раствора ферроцианида. Наличие ионов меди в образце не может быть обнаружено.
Сначала во вторую пробирку наливают раствор NaF — сразу появляется синяя окраска, исходящая от гидратированных ионов меди. Теперь при добавлении раствора ферроцианида калия не будет проблем с подтверждением наличия Cu2+ в образце — коричневый цвет предстанет во всей красе (8). Акт «скрытия» определенных ионов, чтобы они не мешали реакции. камуфляж.
8. Слева направо: раствор солей меди и железа, пробирка после добавления раствора NaF, пробирка после добавления раствора ферроцианида. на этот раз коричневый осадок подтверждает присутствие меди в образце.
Фтор в растворе находится в виде анионов F-, свойства которых отличаются от свойств других галогенов. Вот два примера:
- хлориды, бромиды и иодиды выпадают в осадок с ионами Ag+, фториды — нет;
- фториды кальция, стронция и бария растворяются с трудом, аналогичные соли галогенов — легко.
Надеюсь, что у вас не возникнет трудностей с выполнением соответствующих тестов самостоятельно.

