Неизвестная периодическая таблица, часть 1
Герой статьи — периодическая таблица элементов, та самая, которую вы найдете в каждом школьном учебнике. Однако не разочаровывайтесь, если вы подумали о каком-то секрете, предназначенном только для избранных систем. Табличка Менделеева, которая широко доступна, скрывает много секретов, нужно только их заметить.
Закон периодичности и созданный на его основе, несомненно, является одним из величайших достижений науки. Это позволило систематизировать знания о «кирпичиках», из которых построен наш мир, и использовалось не только в химии, но и в физике, биологии, геологии и многих других областях. Поэтому его по праву включили в школьную программу. Однако …
… школьная фотография …
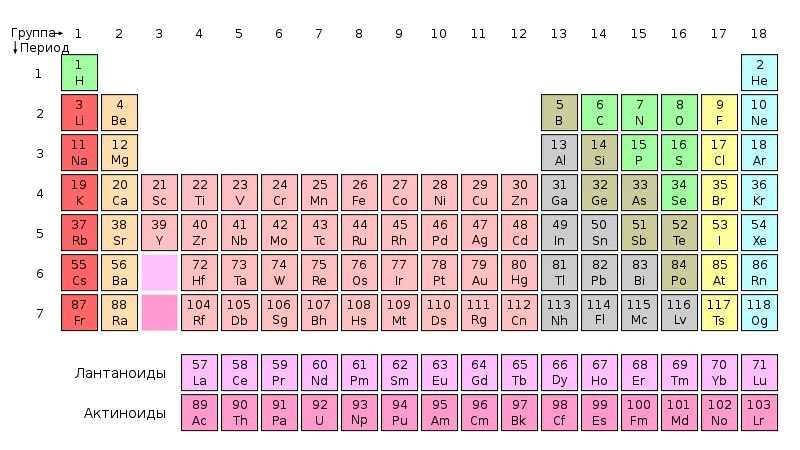
… упрощено, потому что так и должно быть на начальном этапе обучения. Сто восемнадцать элементов разделен на 7 периодов и 18 групп (в длинной версии таблицы Менделеева). Всего имеется две серии из 14 или 15 элементов, номинально относящихся к группе 3. Лантановце i актинидыно вы прочитаете о них позже. Положение элементов в периодической таблице порождает ряд правил, которые составляют содержание заданий в ваших контрольных работах по химии (1).
1. Официальная таблица Периодической таблицы элементов, опубликованная IUPAC.
Например: размеры атомов они уменьшаются в пределах периода (слева направо) и увеличиваются по мере продвижения вниз по группе, причем каждый период начинается с активного металла и заканчивается активным неметаллом и инертным газом. Однако, когда вы выйдете за рамки школьных учебников, вы обнаружите, что правила, которые вы изучали, изобилуют исключениями. Но одно из них бесспорно: обо всех свойствах элемента…
… конфигурация решает …
…электрон, то есть распределение электронов по оболочкам вокруг ядра его атома. Они играют особую роль валентные электроны, то есть те, посредством которых атом контактирует с внешним миром. Слово «контакты» не следует понимать буквально: это не обязательно должны быть только электроны, расположенные на внешней оболочке, они часто располагаются в более глубоких слоях, но обладают наибольшими энергиями в атоме. Это еще один случай, когда идеи, взятые из окружающего нас мира, не соответствуют законам, управляющим микромиром.
Номер периодагде находится данный элемент, также определяет число его электронных оболочек. И из этого правила есть исключение: палладий, находящийся в периоде 5, имеет всего четыре покрытия. Этот факт был обусловлен «ленью» природы, стремящейся минимизировать энергию системы. В случае палладия лучше переносить электроны на нижнюю оболочку (у него есть определенная емкость, поэтому он может удерживать лишь ограниченное количество), но и другие элементы изменяют порядок расположения электронов (определяемый последовательными правилами ), благодаря чему их атомы имеют более низкую энергию.
Точнее, оболочки делятся на подоболочки (если представить сечение атома в виде срубленного ствола дерева, то оболочки представлены годичными кольцами роста, а подоболочки — суточными кольцами роста, которые можно наблюдать внутри оболочек под микроскопом). Разделение на подоболочки хорошо иллюстрирует длинная форма таблицы: подоболочки — это группы 1 и 2 (плюс гелий), p — группы с 13 по 18, d — группы с 3 по 12, а флантаноиды и актиноиды.
2. Таблица периодической таблицы элементов с разделением на энергетические блоки
Конечно, здесь тоже есть многочисленные исключения — элементы, принадлежащие к данному энергетическому блоку, часто не имеют электронов, которые должны были бы иметь в силу своей принадлежности (они передали их для уменьшения энергии атома) (2).
Водородная проблема
Самый легкий газ в периодической таблице находится в группе… лития. Если вы знаете, что названия групп происходят от названия первого элемента в группе, у вас должно возникнуть ощущение, что с водородом что-то не так. Действительно: газ в одной группе с обычными металлами? Правда, они родственны по валентности — у всех элементов из щелочной группы это I (3). Но это единственное сходство с водородом другим «родственникам».
Можно возразить, что и литий, и водород образуют в водном растворе ионы: H+, Li+, Na+ и т. д. Но это уже другая приблизительная картина. Ион водорода — это всего лишь «голый» протон, частица в десятки тысяч раз меньше других ионов. В таком виде он не может существовать в водном растворе, поэтому соединяется с молекулой воды с образованием катиона Н3О+, образования «подходящего» размера, сравнимого с другими ионами (форма Н+ — лишь упрощение в запись уравнений реакции) (4).
Это не относится к другим металлам лития. Водород, однако, образует «нормальные» ионы, они неустойчивы в воде, но содержащие их соединения могут (защищенные от влаги) храниться в виде кристаллов сколь угодно долго. Пример впечатляет: гидрид натрия NaH, кристаллическая структура которого точно такая же, как у NaCl, обычной поваренной соли. Водород существует в форме аниона H-, как и хлор в форме Cl- в хлориде натрия. Был ли водород галогеном?
3. Слева светящийся водород в трубке, справа натрий в парафиновом масле (другие литии выглядят аналогично)
электроотрицательность это способность элемента присоединять электроны. Его значение сближает водород с карбонатами — элементами с промежуточной электроотрицательностью между галогенами, охотно присоединяющими электроны (высокая электроотрицательность) и легко отдающими их литием (низкая электроотрицательность).
4. В таком виде протон присутствует в воде
Итак, литий, галоген или углерод? В случае с водородом ответить невозможно. Это уникальный элемент, который на самом деле не вписывается ни в одну из групп в системе. Такого же мнения и авторы учебников по химии, описывающие водород отдельно от других элементов. Так почему же группа 1? Делалась «ставка» на валентность водорода, и он должен был быть где-то в другом месте.
Проблема с валентностью
Определение валентности элемента по его положению в таблице Менделеева — один из любимых вопросов учителей химии. Школьное правило простое: для групп с однозначными номерами максимальная валентность элемента равна номеру группы, в которой он находится, а для групп с номерами больше 10 — одной цифре в числе. Конечно, с оговорками: гелий 18-й группы «нульоценен» (хотя уже получены соединения ксенона, в которых он имеет максимальную валентность… да, вы догадались — восемь. Так что правило верно.) , а в случае элементов в группах 9 и 10 восходит к чему не более VI. Однако «слепое» доверие правилу быстро собьет вас с пути.
Эта закономерность хорошо работает для групп с 1 по 7 и с 12 по 15. В этих случаях максимальные валентности действительно следуют правилу, указанному ранее (от I до VII и от II до V соответственно). В случае групп 16 (аэробы) и 17 (галогены) низшие элементы удовлетворяют правилу, а кислород (максимальная валентность II) и фтор (только I) — нет. Точно так же железо группы 8 чаще всего имеет валентность II и III и лишь в исключительных случаях VI. Ведущие элементы многих групп, однако, несколько отличаются по своим свойствам от остальных братьев и сестер, что также является одной из особенностей таблицы Менделеева, но об этом в следующем эпизоде.
Максимальная валентность в данной группе не означает, что все элементы семейства одинаково стремятся ее принять. Особенно самые тяжелые из них часто «ленятся» отдавать все доступные электроны для образования связей. Так вот: таллий из 13 группы чаще всего имеет валентность I, свинец из 14 — II, висмут из 15 — III, а радиоактивный полоний из 16 — IV. Существуют также соединения этих элементов с максимально возможной валентностью, но они неустойчивы.
5. Королевское семейство элементов: медь, серебро, золото
Самые странные вещи с валентностью происходят в царской семье, 11-й группе, так как немногие металлы (кроме железа) повлияли на судьбы мира, и они по праву заслуживают это почётное название. — имеет валентность, равную I (если опустить очень неустойчивые и разреженные связи). Но медь обычно двухвалентна и (I) менее прочна.
С другой стороны, для короля металлов нет правил. Самая прочная ценность золота — III (одновалентные связи менее прочны), но также (V) и даже золото (VII). Как будто этого мало, сплав золота с самым активным металлом — цезием — обладает всеми свойствами… соли. Он содержит катионы Cs+ (что и следовало ожидать) и анионы Au-. Соединение CsAu называют золотом или ауридом (от латинского названия царя металлов) цезия. Похожи ли валентности золота на валентности других элементов? Если вы думали о хлоре, поздравляю с вашими знаниями в области химии и проницательностью! Может ли золото быть «замаскированным» галогеном? Во всяком случае, школьное правило определения валентности в случае металлов меди совершенно не работает (5).
Какая доска?
нет ни одного действительный образец периодической таблицы. Организация химиков IUPAC (Международный союз теоретической и прикладной химии) публикует свою периодическую таблицу, но только рекомендует ее использование. За 150 лет с момента разработки первой версии Менделеевым возник ряд различных форм представления закона периодичности (6). Некоторые из них лучше подходят для представления избранных свойств, а есть и такие, которые принимают пространственные, даже художественные формы. Может быть, вы тоже попытаетесь построить свою таблицу Менделеева?
6. Спиральная и пространственная форма таблицы Менделеева (Wikimedia/Szczureq, Wikimedia/Almaak)
Закон периодичности…
… Как это выглядит сейчас: свойства химических элементов, упорядоченные по возрастанию атомного номера, периодически повторяются. В первоначальной формулировке 1869 г. критерием упорядочения была атомная масса (или, как тогда говорили, атомный вес). К счастью для Менделеева атомная масса вообще пропорциональна атомному номеру (количеству протонов в ядре элемента), благодаря чему ему удалось разгадать «химический пасьянс» (7).
В середине девятнадцатого века было всего две аномальные пары, т. е. два соседних элемента, из которых, имея большую атомную массу, помещали впереди более легкой системы (кобальт и никель, теллур и йод). Менделеев считал, что атомные массы были определены неправильно, и располагал элементы по их химическим свойствам (многочисленные попытки исправить атомные массы неправильных пар, предпринятые в последующие годы, не дали никаких результатов). В конце века появилась треть аномальных пар: аргон и калий. После открытия строения атомного ядра оказалось, что решение Менделеева было правильным.
7. Таблица Менделеева в учебнике 1871 г. с пробелами для еще не открытых элементов.

