Комплексные соединения, часть VI — Хелатные комплексы
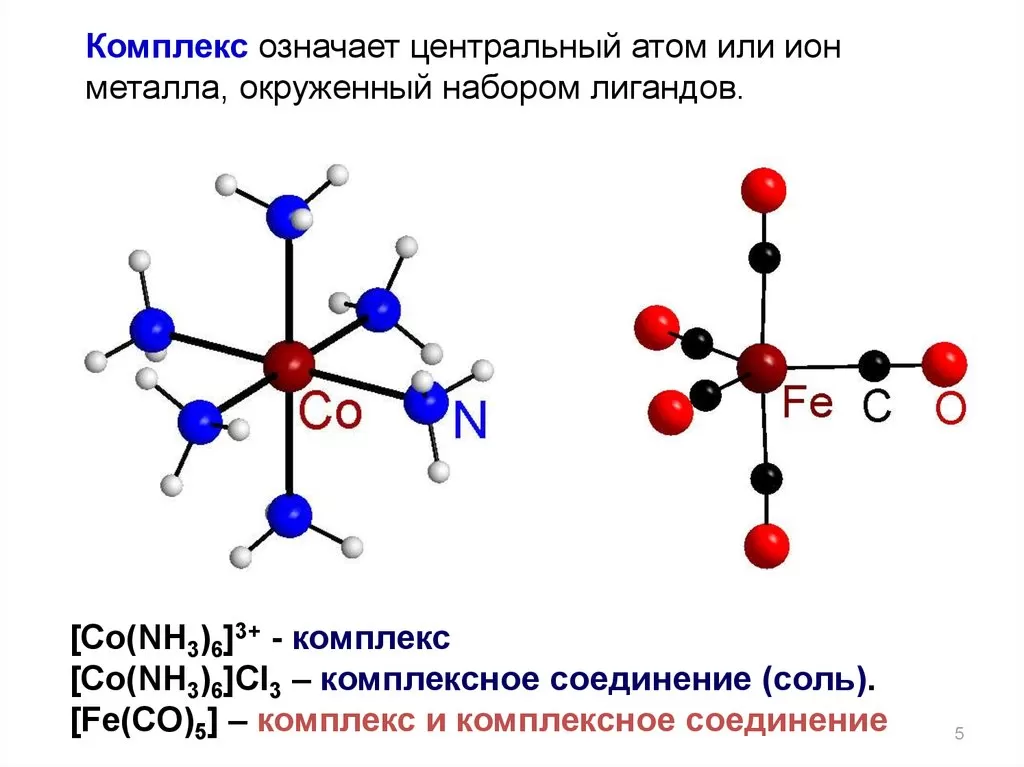
Есть много лигандов, которые могут связываться с центральным ионом более чем одной координационной связью. Соединения, обладающие этим свойством, называются мультидентатными лигандами, а образуемые ими комплексы — хелатами (от греч. chele = раковая щипка). В следующих экспериментах мы получим несколько металлохелатных комплексов.
В первом опыте проведем реакцию между ионами меди (II) и аминоуксусной кислотой (глицином, одной из белковых аминокислот). Для проведения теста потребуются растворы медного купороса CuSO.4 и глицин Н.2N-ТОЛЬКО2-COOH (фото 1). В пробирку налейте небольшой объем раствора синей соли меди, а затем добавьте немного раствора аминоуксусной кислоты (фото 2). Содержимое сосуда становится лазурным. Явление обусловлено образованием хелатного комплекса ионов меди (II) с анионами глицина: Цвета обоих соединений представлены на фото 3: слева — аквакомплекс, справа — комплекс с глицином.
При второй попытке получим комплекс ионов железа (III) с салициловой кислотой. Для эксперимента потребуются водные растворы хлорида железа (III) и FeCl.3 и салициловая кислота С.6H4(ОН) СООН. Вместо чистого органического реагента можно использовать салициловый спирт – доступное в любой аптеке дезинфицирующее средство, представляющее собой 1%-ный спиртовой раствор этой кислоты (фото 4). Налейте в пробирку немного желто-красного раствора FeCl.3а затем добавить несколько капель салицилового спирта (фото 5). Содержимое сосуда меняет свой цвет на сине-фиолетовый в результате образования хелатного соединения: Жидкость в пробирке имеет вид чернил. Неудивительно — чернила сделаны из соединений, близких по структуре к салициловой кислоте. Проведенная реакция представляет собой характерную попытку обнаружения фенолов — соединений, в которых ОН-группа связана с бензольным кольцом (эта группа также присутствует в молекуле салициловой кислоты). На фото 6 представлены цвета обоих соединений: слева — аквакомплекс, справа — хелат.
Одним из применений мультидентатных лигандов является определение содержания катионов металлов в растворах. Аналитический метод – титрование, заключающееся в добавлении к испытуемой пробе раствора реагирующего с ней вещества (с известной концентрацией). Об окончании титрования чаще всего свидетельствует изменение окраски соответствующим образом подобранного индикатора. Зная объем использованного титр-раствора, можно рассчитать содержание определяемого катиона в пробе.
Для проведения титрования ионов кальция в водопроводной воде будем использовать раствор ЭДТА (натриевая соль эдетовой кислоты), индикатор с торговым названием «Кальмагит» и аммиачную воду (фото 7). Начинаем эксперимент с добавления капли водного раствора аммиака в отмеренный объем водопроводной воды (фото 8), что необходимо для обеспечения щелочной реакции среды (для правильного выполнения теста требуется рН около 10).
Теперь добавьте в стакан каплю индикаторного раствора (фото 9), который окрасит содержимое сосуда в красный цвет. Затем набираем в маленькую пипетку раствор ЭДТА и капаем в сосуд с образцом (фото 10). После добавления каждой капли содержимое перемешивают встряхиванием стакана. Об окончании титрования свидетельствует быстрое изменение окраски раствора на синюю (фото 11).
ЭДТА образует с ионами кальция хелатное соединение следующего строения:
Хелатные комплексы — первый опыт
Хелатные комплексы — второй опыт
zp8497586rq

