|
 | Аккумуляторы работают, накапливая энергию и высвобождая ее, когда электрическая цепь замыкается. Энергию можно использовать и использовать для создания света, тепла или движения. Эту энергию чаще называют электричеством. |
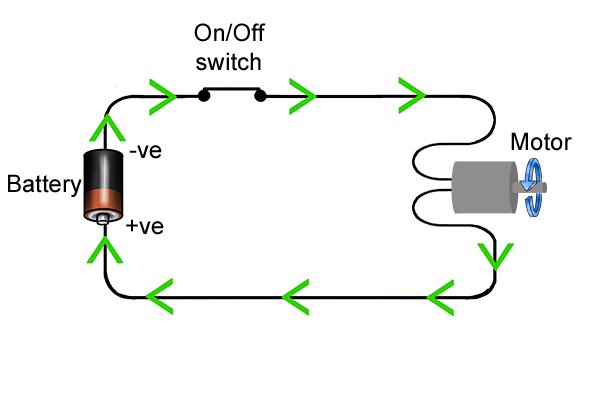 | Когда вы нажимаете кнопку включения беспроводного электроинструмента, вы замыкаете электрическую цепь, которая позволяет энергии течь от аккумулятора к инструменту и заставляет, например, сверло вращаться. |
 | Аккумулятор может хранить только ограниченное количество энергии, и когда он разрядится, его необходимо перезарядить с помощью зарядного устройства. Зарядное устройство использует электроэнергию из сети, чтобы пополнить аккумулятор энергией, и оно снова готово к работе. |
 | Если вам интересна химия, благодаря которой все это работает, читайте дальше! |
Аккумуляторная химия |
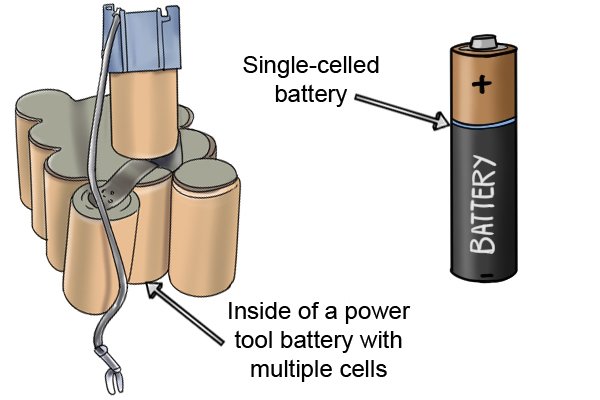 | Аккумуляторная батарея, предназначенная для беспроводных электроинструментов, состоит из нескольких аккумуляторных «ячеек» и известна как аккумуляторная батарея. Чем больше ячеек, тем больше работы может выполнить аккумулятор, прежде чем разрядится. |
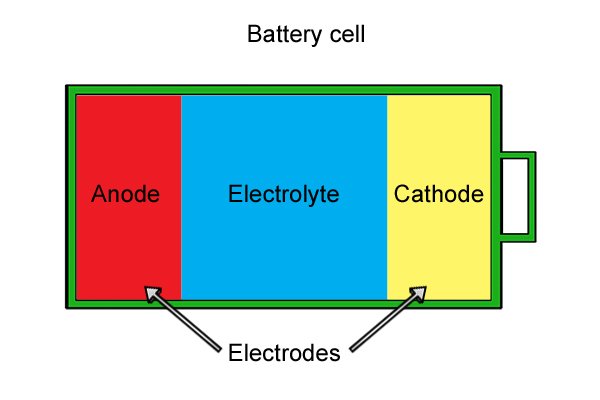 | Внутри каждой ячейки есть анод, катод и электролит. Анод и катод, известные под общим названием «электроды», сделаны из материалов, которые вступают в реакцию, если их соединить вместе. Электролит представляет собой жидкость или влажную пасту, которая отделяет электроды друг от друга. |
 | Все в мире состоит из крошечных молекул, которые взаимодействуют на основе своего электрического заряда (положительного, отрицательного или нейтрального). Чтобы понять аккумулятор, нам нужно посмотреть, как молекулы в электродах взаимодействуют друг с другом. |
 | Молекула состоит из одного или нескольких атомов, которые являются мельчайшими строительными блоками. |
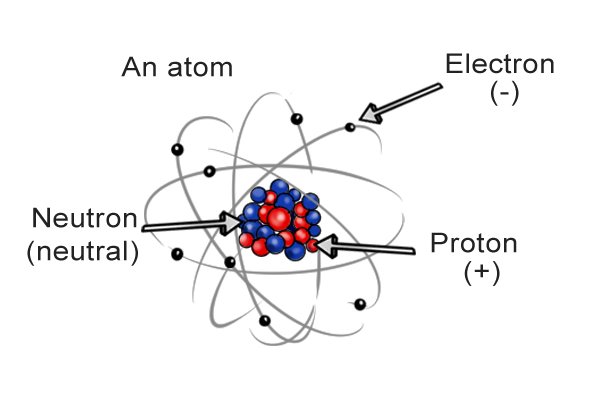 | Каждый атом имеет в центре «ядро», содержащее нейтроны и протоны. Вокруг ядра вращаются электроны. Нейтроны имеют нейтральный заряд, протоны — положительный, а электроны — отрицательный. Баланс между зарядами определяет общий заряд атома, а баланс между атомами в молекуле определяет общий заряд молекулы. |
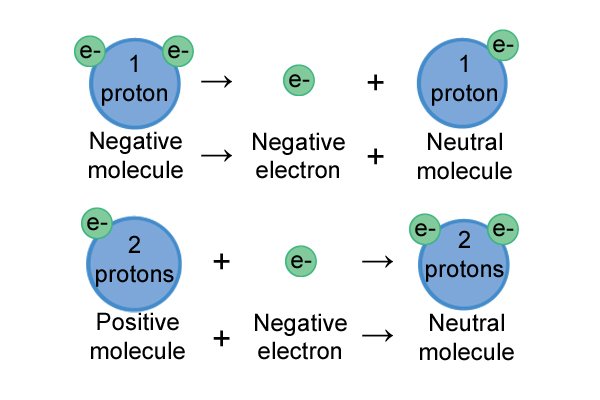 | Каждая молекула хочет стать нейтральной. Единственный способ, которым они могут это сделать, — это потеря или приобретение электронов. Если у них общий положительный заряд, они притягивают электроны, если у них общий отрицательный заряд, они теряют электроны. |
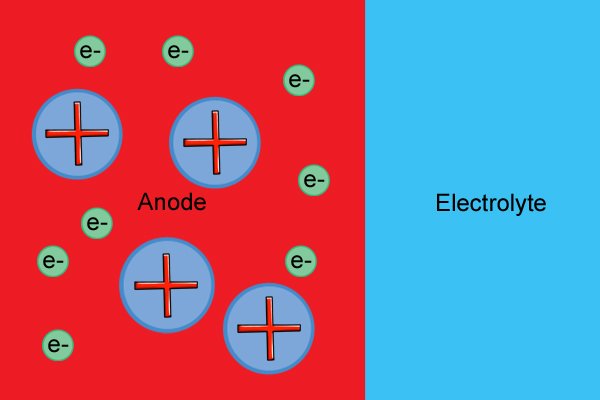 | Молекулы анода имеют нейтральный заряд до тех пор, пока они не вступают в реакцию с электролитом, что вызывает высвобождение электронов (известное как «реакция окисления») и образование положительных ионов (заряженных молекул). |
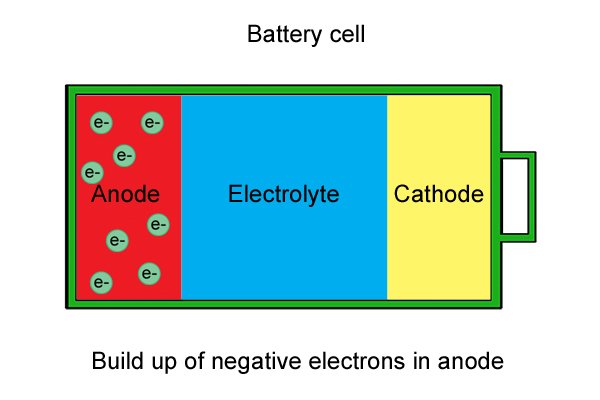 | Эти «свободные» электроны накапливаются в аноде, делая его отрицательным. |
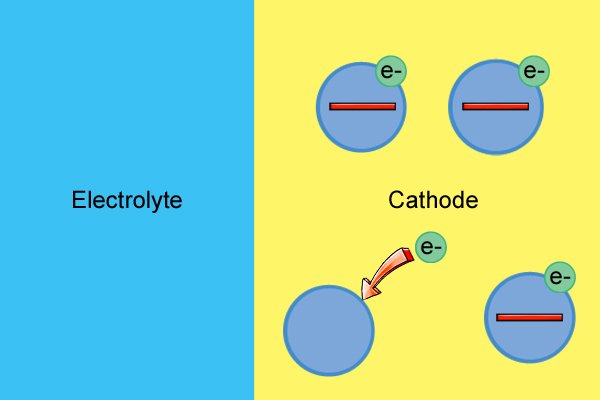 | Молекулы катода также имеют нейтральный заряд, пока они не начнут реагировать с электролитом, который использует свободные электроны и образует отрицательные ионы (известная как реакция восстановления). |
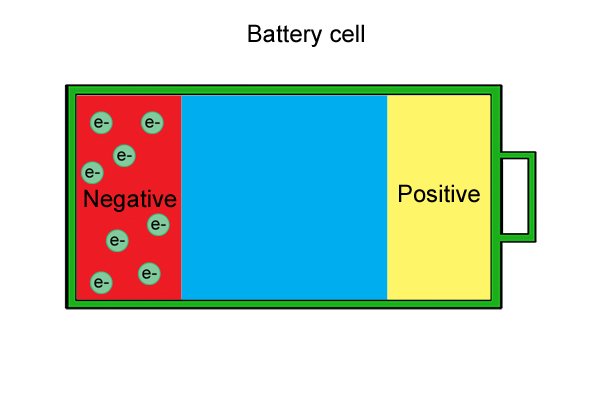 | Потребление свободных электронов приводит к тому, что катод становится все более положительным до тех пор, пока электронов не останется. |
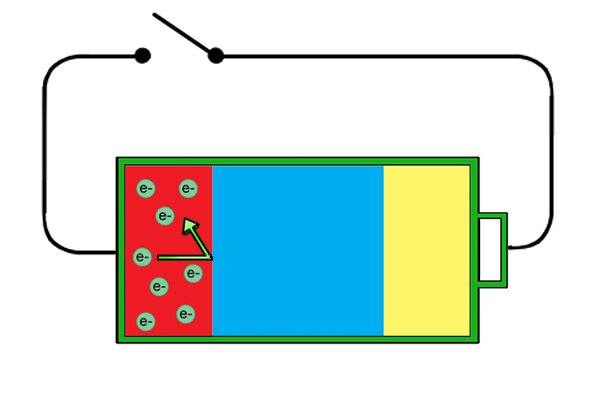 | Анод теперь отталкивает электроны, а катод требует их, но если цепь неполная, свободные электроны в аноде не могут перейти к катоду, потому что они не могут пройти через электролит. |
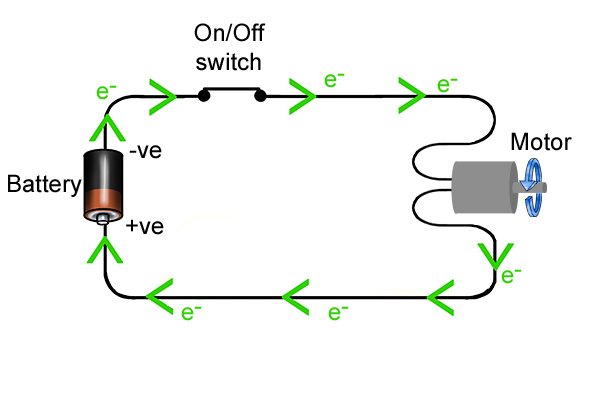 | Когда цепь замыкается, свободные электроны могут течь по проводнику от анода к катоду. Когда они проходят через инструмент, энергия, которую они несут, может использоваться для выполнения «работы», такой как поворот сверла в аккумуляторной дрели. |
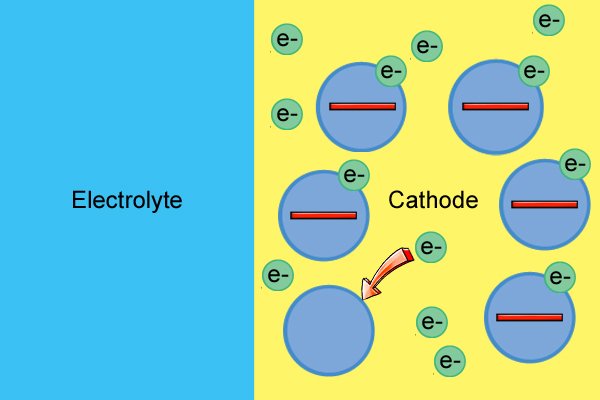 | Когда они достигают катода, они поставляют электроны для продолжения реакции восстановления, производя еще больше отрицательных ионов по мере добавления электронов. |
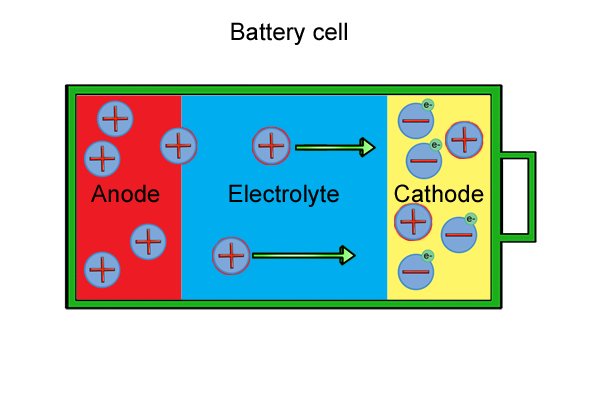 | Между тем, в аноде потеря электронов приводит к образованию еще большего количества положительных ионов, которые притягиваются к отрицательным ионам на катоде, поэтому положительные ионы начинают двигаться через электролит и смешиваться с отрицательными ионами на катоде. |
 | Как только все положительные ионы перемещаются к катоду и свободных электронов больше не остается, батарея перестает работать должным образом и ее необходимо перезарядить. |
 | Зарядные устройства пропускают напряжение, которое выше, чем напряжение батареи, через разряженную батарею. Это приводит к тому, что реакции в аккумуляторе меняются на противоположные. |
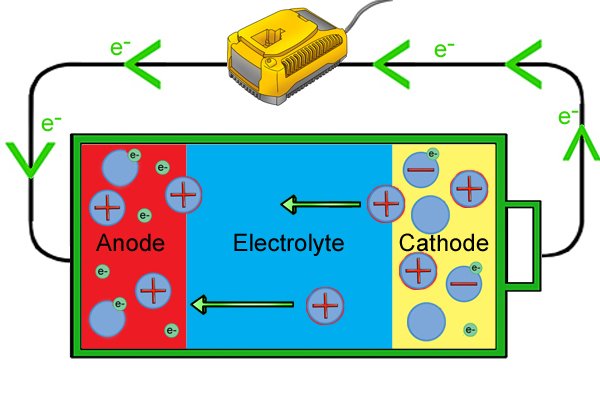 | Ввод электричества от зарядного устройства заставляет электроны в катоде возвращаться по цепи к аноду. По мере того, как анод становится все более отрицательным из-за всех электронов, положительные ионы анода начинают покидать катод и двигаться через электролит обратно к аноду, где они присоединяются к свободным электронам и снова становятся нейтральными. |
 | Аккумулятор снова готов к работе! |
























