гальванические элементы
Встречи с электрохимией, часть 4
Предыдущее собрание было посвящено первым гальваническим элементам, созданным в Европе в начале XNUMX века. Мы завершили статью выводом: хотя батареи, изобретенные итальянским ученым Алессандро Вольта, позволили сделать многие открытия в области физики и химии, их конструкция была сложной в использовании. В предлагаемых сегодня экспериментах мы усовершенствуем построенные системы и, кроме того, узнаем, как работают гальванические элементы.
Как работают гальванические элементы
Ссылка не работает?
Так? работать! Берем две маленькие мензурки. Одна из них заполнена раствором сульфата меди (II) CuSO (VI)4и другие? ZnSO сульфат цинка4. Оба раствора должны иметь одинаковую концентрацию 0,1-1 моль/дм.3. Затем мы готовим жабры? цинк и медь, тщательно очищая металлические поверхности. Прикрепляем их к кусочкам дерева или жесткого пластика (каждый к отдельному каркасу). Соединяем концы электродов с выводами вольтметра. Кроме того, параллельно измерителю подключите в цепь небольшую лампочку с рабочим напряжением 1,5 В. Погрузите электроды в стаканы (стойки упираются в края сосудов) и наблюдайте за показаниями счетчика и лампочкой. Ничего не произошло! Помимо возможности неаккуратной проводки, где-то должна быть ошибка. Давайте еще раз посмотрим на наш макет. Цепь не замкнута? каждый электрод находится в отдельном стакане, и ионы не могут течь. Должна существовать возможность обмена носителями заряда между растворами. Но как это сделать?
Электролитический ключ
В лабораториях для этой цели используют электролитический ключ. Представляет собой стеклянную U-образную трубку, заполненную концентрированным раствором соответствующим образом подобранного электролита, закрытую с обеих сторон пористым материалом (пеностеклом или слоем геля). Устройство обеспечивает электрическое соединение растворов, предотвращая их смешивание. Нам также предстоит изготовить электролитический ключ.
Гальванические элементы — электролитический ключ
Есть несколько возможностей:
1. У нас есть U-образная трубка нужного размера или мы можем согнуть нужную форму из прямой стеклянной трубки (в пламени газовой горелки). Остается заполнить его раствором электролита максимально возможной концентрации и закрыть выходные отверстия с двух сторон плотно скрученной фильтровальной бумагой или ватой. Другое решение состоит в том, чтобы заполнить трубку раствором желатинового электролита. После того, как гель затвердеет, у нас есть готовый к использованию электролитический ключ. В качестве электролитов используем KNO растворы нитрата калия (V).3, сульфат калия (VI) K2SO4 или хлорид калия KCl. Помните, однако, что часть ионов из ключа должна перейти в раствор, чтобы обеспечить электрический контакт. С некоторыми растворами электродов невозможно использовать K2SO4 или KCl из-за возможного осаждения? нитрат калия является наиболее подходящим.
2. Без стеклянной U-образной трубки не менее хороший ключ получается из пластиковой трубки, согнутой в нужную форму. Примечания по заполнению раствором электролита Пластик? ключи такие же, как в шаге 1.
3. Кусок толстой хлопчатобумажной нити (или сложенная в несколько раз полоска фильтровальной бумаги), пропитанный раствором электролита, также будет служить электролитическим ключом.
Соединяем растворы в мензурках с любым электролитическим ключом и работает!
ссылка Даниэлы
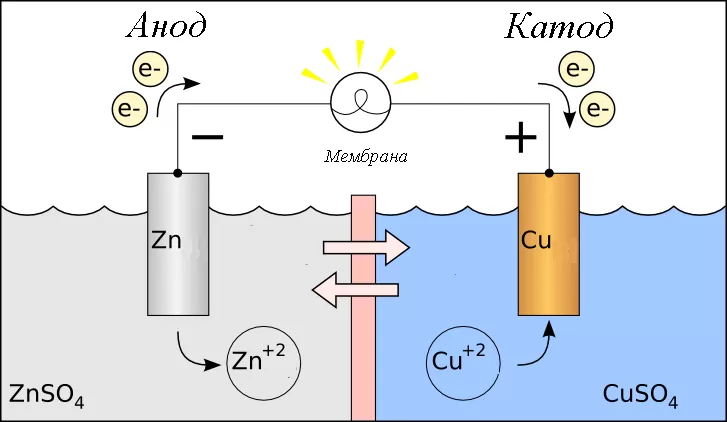
Только что построенная система называется ячейкой Даниэллы. В 1836 году он был построен английским химиком и физиком Джоном Фредериком Даниэлем (17901845-XNUMX). Отрицательный электрод представляет собой цинковую пластину, а положительный электрод — медную пластину:
Схема клетки следующая:
В примечании указана концентрация растворов в стаканах и символ двойной вертикальной линии || обозначает электролитический ключ.
Теперь давайте вытащим ключ из стаканов. Лампочка тут же гаснет и показания счетчика падают до нуля (раньше было почти 1,1 В). С электродами ничего не происходит (они не растворяются). Если положить ключ обратно в мензурку, ячейка снова заработает. Итак, мы устранили один из недостатков элемента Вольта? расход электродов неработающей ячейки. Однако второе неудобство осталось? растворы жидких электролитов. И ячейки типа Вольта (с общим раствором электролита для электродов), и ячейки Даниэллы (с отдельными электролитами для отдельных электродов) работают в жидкой среде. Несмотря на этот недостаток, ячейка Даниэллы была усовершенствованием конструкции Вольта и использовалась в конструкции электрических телеграфов, изобретенных в то время.
Разновидностью ячейки Даниэлла является конструкция, в которой оба электролита находятся в одном сосуде. Чтобы предотвратить смешивание электролитов, используется пористая стеклянная диафрагма, которая обеспечивает ограниченный перенос ионов между растворами, обеспечивая электрический контакт и замыкая цепь. В бытовых условиях роль диафрагмы будет играть кусок картона, вплотную прилегающий к реакционному сосуду.
Итак, давайте сделаем измененную ссылку Даниэллы. Разделите мензурку кусочком картона (дополнительно с помощью пластилина или санитарного силикона можем заклеить места соединения стенок мензурки и бумаги). Налив растворы в обе части стакана, подождите некоторое время (чтобы картон пропитался жидкостью), а затем вставьте электроды. Ссылка уже должна работать. Диафрагма на схеме звеньев отмечена вертикальной линией с пробелом посередине
Как работают клетки?
Мы уже знаем, как конструировать клетки, но еще не знаем механизма их действия. Итак, настало время некоторых пояснений (в несколько упрощенной форме).
В металлах носителями заряда являются свободные электроны. Это означает, что рядом с ними должны быть положительные ионы (весь любой фрагмент металла электрически нейтрален). Итак, металлы состоят из катионов, находящихся в узлах кристаллической решетки, окруженных подвижными электронами. После погружения металлического электрода в раствор небольшая часть (визуально не поддающаяся обнаружению) катионов на поверхности покидает свои места и переходит в жидкую фазу. Однако катионы далеко не уходят? удерживаются вблизи поверхности электрода силами электростатического притяжения (лишние электроны остались в металле). Весь процесс занимает доли секунды. С этого момента электрод находится в равновесии с раствором? в единицу времени с его поверхности уходит такое же количество ионов, которое осаждается обратно на нее. Для каждого из металлов равновесие устанавливается на разном уровне.
После соединения электродов из разных металлов электроны будут двигаться оттуда, где их больше, туда, где их меньше. Первый является анодом ячейки, а второй? катод. Очевидно, поток электронов нарушает установившееся равновесие. Как следствие (сравните процессы, происходящие на аноде и катоде, зарегистрированные для ячейки Даниэля):
- на отрицательном аноде электронов становится меньше, поэтому все больше и больше катионов металлов переходит в раствор;
- электроны присоединяются к положительному катоду, что означает, что катионы в растворе осаждаются на электроде.
В целом раствор электролита электрически нейтрален, поэтому избыток или недостаток катионов металлов необходимо компенсировать за счет миграции соответствующих ионов из ключа электролита. Так работают гальванические элементы.
Полуклеточные потенциалы
В конструкции камеры Даниэллы видны две похожие детали? электроды, погруженные в раствор электролита. Эти составные части являются полукамера (каждый элемент должен состоять из двух полуэлементов, в случае элемента Вольта электролит общий для обоих электродов). В каждой полуячейке устанавливается равновесие между ионами в растворе и электронами в материале электрода. Является ли состояние равновесия, ведущее к разделению зарядов, источником электрического потенциала? разные для разных металлов. Однако нельзя ли определить абсолютный потенциал отдельной полуклетки? мы всегда измеряем разность потенциалов двух тел. В случае с клетками это называется ЭДС.
Поэтому необходимо выбрать электрод сравнения, относительно которого будут измеряться потенциалы. В качестве стандартной системы был выбран водородный электрод, изготовленный из платиновой пластины, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/дм.3 и промывают потоком газообразного водорода. Потенциал водородного электрода принимался равным нулю и относительно него определялись потенциалы остальных полуячеек. Из-за технических трудностей использования водородного электрода на практике в качестве системы отсчета используют другие электроды с точно известным потенциалом.
Читатель может быть удивлен, обнаружив в таблице потенциалов стандартные металлы, такие как натрий и калий. Ведь нельзя же из этих металлов строить электроды и погружать их в водный раствор? сразу растворится. Потенциалы натриевого электрода (и ряда других) не измерялись, а вычислялись на основании данных о теплоте превращений, происходящих с участием атомов и ионов этих металлов.
Как использовать таблицу потенциалов полуэлемента для расчета ЭДС клетки?
1. Закрепляем электроды ячейки. Анод представляет собой полуэлемент с более низким стандартным потенциалом, а катод? о выше.
2. ЭДС ячейки – это разность потенциалов катода и анода (должна быть положительной величиной):
Например, для ссылки Daniella:
В случае цинково-железного элемента оба электрода имеют отрицательные стандартные потенциалы. Однако даже в этом случае железный катод («плюсовые» ячейки) имеет более высокий потенциал, чем цинковый анод, и расчетная ЭДС положительна. Отрицательные стандартные потенциалы электродов из этих металлов являются лишь следствием выбора водородного электрода в качестве «нулевого». по шкале потенциалов. ЭДС элемента зависит не только от выбора полуэлементов, но и от других факторов (в том числе от состава раствора электролита, внутреннего сопротивления, температуры, степени подготовки поверхности электродов), а также уменьшается по мере износа реагенты. Помните об этом, если мультиметр не показывает рассчитанное нами напряжение.
Стандартные потенциалы E0 некоторые полуэлементы, измеренные относительно водородного электрода при 298 К (25?С). Например: Zn2+/ Zn означает электродную реакцию:

