фенолофталины
Фенолфталеин является одним из наиболее часто используемых индикаторов pH. В школе мы узнаём, что в щелочной среде он меняет цвет: от бесцветного до малинового. Однако следующие эксперименты покажут, что фенолфталеин имеет гораздо более богатую цветовую палитру.
В первой попытке проверим поведение индикатора в растворах с разным рН. Требуемые реагенты: 1% спиртовой раствор фенолфталеина, примерно 30% раствор серной кислоты (VI) H2SO4 (разбавить коммерческий раствор водой в соотношении 1:2), около 30% раствор гидроксида натрия NaOH. Начнем опыт с помещения на несколько см в пробирку3 раствор Х.2SO4. Капля индикаторного раствора, введенная в пробирку, вызывает окрашивание содержимого в оранжевый цвет. Цвет исчезает при добавлении небольшого количества воды (фотография 1). Налейте на несколько см в следующую пробирку3 воды и добавить каплю раствора NaOH, а затем каплю индикаторного раствора — на этот раз фенолфталеин ведет себя «правильно» и окрашивает содержимое сосуда в малиновый цвет (фотография 2). В следующей части эксперимента налейте в пробирку на несколько см3 концентрированного основного раствора и добавить каплю индикаторного раствора. Первоначальное обесцвечивание быстро исчезает. Если теперь добавить небольшое количество раствора кислоты, появится малиновый цвет (фотография 3).
Реакции, которые отвечают за эффекты проведенных тестов, следующие:
1. В сильнокислом растворе (pH <0) бесцветная форма фенолфталеина превращается в карбокатион оранжевого цвета:
Реакция обратима и при разбавлении водой (уменьшение кислотности, т.е. повышение рН) восстанавливается бесцветная форма индикатора.
2. «Нормальное» поведение фенолфталеина в щелочном растворе (pH > 8,2) заключается в образовании так называемых система сопряженных двойных связей, охватывающая всю молекулу. Он отвечает за интенсивный цвет этой формы индикатора:
Конечно, закисление окружающей среды (pH <8,2) приводит к обесцвечиванию.
3. В сильнощелочной среде (pH>12) окрашенная форма фенолфталеина переходит в бесцветную (разрушается система сопряженных двойных связей всей молекулы):
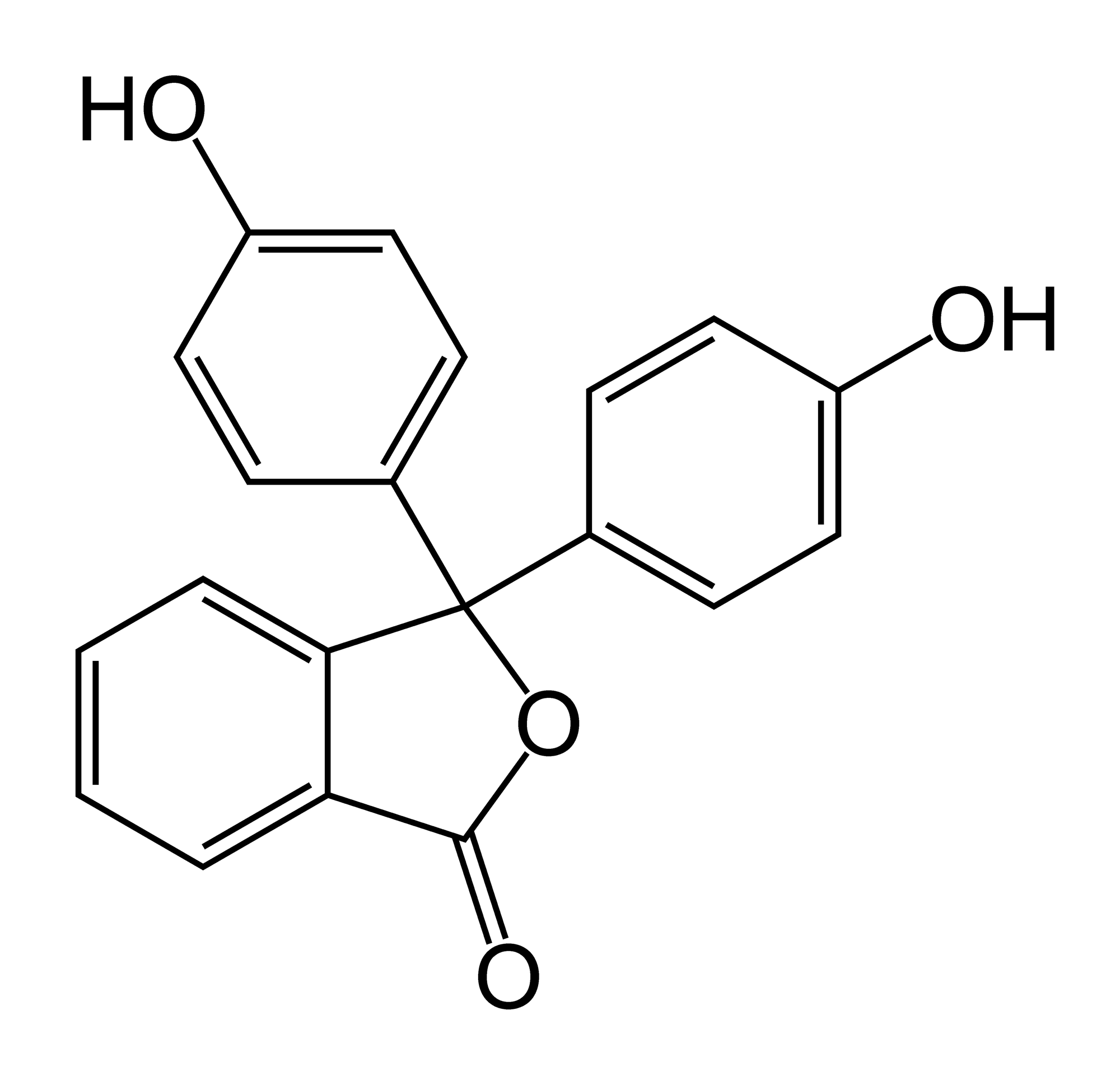
Реакция обратима, и подкисление среды восстанавливает малиновый цвет пробы. Все полученные формы фенолфталеина представлены на рис. фото 4.
Фенолфталеин используется в качестве реактива для обнаружения следов крови. Аналитическая процедура называется тестом Кастле-Мейера. Для приготовления реактива потребуются: гидроксид калия КОН, фенолфталеин и цинковые опилки или пыль. Насыпьте в банку на дюжину или около того см.3 воды, насыпьте несколько гранул гидроксида, цинковую пыль и немного фенолфталеина. Закрываем сосуд, ставим в кастрюлю с водой и начинаем нагревать на водяной бане (время от времени открываем крышку, чтобы уравнять давление). Через 0,5-1 час содержимое сосуда меняет цвет с интенсивно-малинового на желтоватый (фотография 5). Это признак того, что реакция закончилась — цинк снизил индекс до соединения, называемого фенолфталин. Готовый реактив Кастле-Мейера хранят в закрытом сосуде, в темном месте и смешивают с цинковой пылью (удобнее всего оставить в банке).
Перекись водорода (3% раствор перекиси водорода H2O2) и следы крови, например, на повязке, снятой с раны (фотография 6). Наносим несколько капель реактива на поверхность (фотография 7), а затем такое же количество перекиси водорода (фотография 8). При наличии следов крови проба окрашивается в розовый цвет (фото 9 и 10). Это положительный тест Кастле-Мейера.
Гемоглобин крови расщепляет H.2O2а выделившийся кислород окисляет фенолфталин до фенолфталеина. В среде щелочной реакции приобретает характерную окраску. Однако окраска должна появиться за время, не превышающее 30 секунд, так как через большее время фенолфталин окисляется кислородом воздуха и появляется окраска анализируемого образца. Тесту мешает загрязнение образца веществами, разлагающими перекись водорода (например, ферментами растений). Тест Кастле-Мейера используется в судебно-медицинской экспертизе.
Смотрите наши видео:
