Электрохимический ряд
Содержание
Встречи с электрохимической частью 6
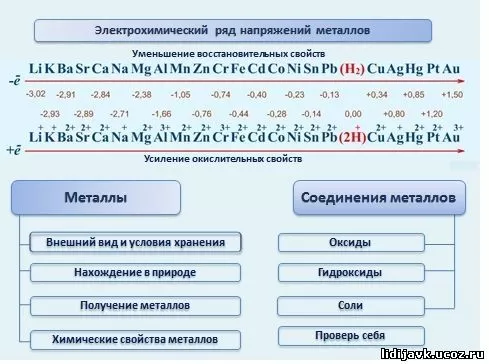
На третьем собрании нашего цикла мы расположили некоторые металлы по порядку, приняв за критерий потенциал соответствующей системы. Напомним порядок расположения полуячеек по возрастанию эталонных потенциалов (электроды пишутся сокращенно — только символы металлов и водород в качестве «нулевой» шкалы):
Li K Ca Na Mg Al Zn Mn Cr Fe Co Ni Sn Pb H2 Bi Cu Ag Hg Pt Au
Последовательность называется электрохимическим (или напряжением) рядом, и ее знание и умелое использование имеет большое значение в работе химика.
Смещение металла
Простой, но поучительный эксперимент для начала. Подготовьте пластины: цинковые и медные, тщательно очистив их поверхность от потускнения и отшлифовав наждачной бумагой. Готовим примерно 10% растворы сульфата меди(II) CuSO(VI)4 и сульфат цинка ZnSO4. Наполните ими мензурки, затем опустите цинковую пластинку в раствор соли меди (II), а медную пластинку в мензурку с раствором соли цинка. Через некоторое время серебристая поверхность цинка краснеет (для достижения красивого эффекта важно сгладить поверхность, в случае неаккуратной очистки цинк только темнеет). Металлическая медь осаждается на пластине. Протекающий процесс можно записать уравнением реакции:
Zn0 + медь2+ ? цинк2+ + медь0 ?
Поэтому атомы цинка окисляются до двухвалентных катионов и переходят в раствор, а ионы меди (II) ? они восстанавливаются до металла, который осаждается на поверхности цинка.
Однако во втором стакане изменений не наблюдалось. Ионы цинка не реагируют с металлической медью. Это объясняет положение металлов в ряду напряжений. Цинк находится левее меди, значит, потенциал цинкового электрода меньше, чем у медного полуэлемента. Таким образом, в окислительно-восстановительной реакции окислителями будут ионы меди (II) (в медной полуячейке только ионы Cu2+ может принимать электроны и атомы меди Cu0 ? вернуть их), а атомы цинка в качестве восстановителей. Это объясняет реакцию, происходящую в первом стакане. Процесс соответствует уравнению, написанному выше (справа). С другой стороны, невозможно изменить направление реакции (против часовой стрелки), поскольку ионы цинка являются слишком слабым окислителем, чтобы окислять металлическую медь.
Средневековые алхимики называли подобный процесс «вытеснением металла»; этот термин используется до сих пор. Поэтому говорят, что более активный металл (менее благородный, расположенный слева в ряду напряжений) вытесняет из раствора соли менее активный металл (более благородный, находится справа), т. е. занимает его место в структуре соединения. Основоположник флогистонной теории горения немецкий химик и врач Георг Эрнст Шталь (1659-1734) заметил в 1697 г., что серебро из раствора его солей может вытесняться металлической медью, а железо, в свою очередь, выделяется при влияние металлического цинка. Таким образом, Шталь создал прототип серии напряжений.
Разведение металлов
Мы проведем некоторые эксперименты, которые уже очаровали алхимиков, наших «химических предков». Для первого опыта вам понадобится азотнокислое серебро AgNO.3 (ляпис; а это название дали алхимики, считавшие соединение, оставляющее черные пятна на коже, «адским камнем»? ? на латыни) и медный провод. Очистите медь и согните проволоку, чтобы получилась модель дерева с несколькими ветвями. Размер конструкции зависит от размера имеющейся у вас мензурки. Поместите дерево в сосуд, прикрепив его ко дну.

Приготовьте 5% раствор лазурита и залейте его, пока он не покроет всю модель. В мгновение ока на поверхности медных проводов начинают расти серебряные иглы, придавая конструкции вид растения, покрытого инеем. Алхимики называли его деревом Дианы? (серебро было посвящено римской богине охоты). Однако мы модифицировали первоначальный эксперимент, поскольку алхимики выращивали дерево из серебряной амальгамы в среде азотной кислоты (V). Через несколько минут вы заметите обесцвечивание раствора, который теперь стал явно синим. Конечно, за этот цвет ответственны гидратированные ионы меди (II):
Cu0 + 2Аг+ ? С участием2+ + 2Аг0 ?
Если эксперимент удался и мы получили эффектный экземпляр, мы можем зафиксировать его в желатине. Для этого осторожно (чтобы кристаллы серебра не упали с веточек) выньте конструкцию из стакана. Затем ждем, пока стечет лишний раствор и прикрепляем деревце ко дну банки, в которой будем его хранить. Приготовить 2-3% раствор желатина в горячей воде и после остывания осторожно влить в банку. Когда желатин застынет, закрываем банку и можем похвастаться своей работой.
Чуть менее эффективные результаты мы получим путем «разведения»? очередной экземпляр? алхимическое «дерево Сатурна». Он сделан из ацетата свинца (II) (CH3главный операционный директор)2Pb (Сатурн был посвящен свинцу) и металлический цинк. Никому не нужно напоминать об осторожности при проведении испытаний с соединениями свинца, особенно с полностью растворимым в воде ацетатом. Соединение имеет сладковатый вкус и в просторечии называется «Свинцовый сахар». (так же называют алхимики), но ни в коем случае нельзя проверять предоставленную информацию? ацетат свинца это настоящая?белая смерть?! Вырежьте форму дерева, например, новогоднюю елку, из цинковой пластины. Закрепляем его на нитке и опускаем в мензурку, наполненную 3-5% раствором свинцового сахара. Металлический свинец осаждается на поверхности цинка в виде темных кристаллов:
Zn0 + Pb2+ ? цинк2+ + Pb0 ?
При освещении фонариком елка начинает сиять, как настоящая новогодняя елка, покрытая снегом.
Анализируя ряды напряжений, мы можем сами спроектировать «разведение». Например, так: тщательно очищенная цинковая пластина разрезается на узкие полоски, а затем стыкуется в произвольную форму. Растворить хлорид олова (II) SnCl в воде.2 (концентрация 5-10%). Погрузите конструкцию, прикрепленную к нити, в стакан, наполненный этим раствором. Через несколько минут снимите скелет, покрытый длинными шипами из металлического олова:
Zn0 + Сн2+ ? цинк2+ + Сн0?
Как назвать нашу работу? Олово — это металл, связанный с планетой Юпитер, так что, может быть, это дерево Юпитера?
Химическое покрытие
Замещение одних металлов другими имеет большое практическое значение. Их используют для промышленного получения золота и серебра (воздействуя цинком на растворы соединений этих металлов). Метод также применяется для нанесения декоративных покрытий (ювелирные изделия, консервация памятников). Однако слои очень тонкие (максимум порядка 0,001 мм) и нет возможности увеличить их толщину.
Причина проста: осаждение металла на подложку изолирует его от раствора, останавливая процесс вытеснения. В бытовых условиях возможно химическое меднение и серебрение. Помните, что залогом достижения хороших результатов является предельно тщательная подготовка поверхности покрываемого предмета: удаление загрязнений, обезжиривание и тщательная шлифовка мелкозернистой наждачной бумагой. В противном случае мы получим еще одно «дерево», которое может выглядеть интересно, но полученное покрытие не защищает и не украшает объект.
Во-первых, меднение стали. Готовим ванну растворением 5-10 г медного купороса (II) CuSO в XNUMX л воды4 и столько же серной кислоты (VI) H.2SO4 (что соответствует примерно 3-6 см3 концентрированный раствор кислоты). Не используйте более высокую концентрацию солей меди, потому что, чем более разбавлен раствор (выделение металла происходит медленнее), тем лучше сцепление покрытия с подложкой. Тем не менее осаждение меди из такой ванны происходит очень быстро, достаточно погрузить стальной предмет на 30-60 секунд. Вынув его из ванны, промойте водой, высушите и аккуратно отполируйте мягкой тканью.
Медные покрытия с гораздо лучшей адгезией к подложке можно получить в ванне, содержащей комплексные соединения меди (II). Для этого приготовьте раствор, растворив примерно 50 г кристаллического CuSO в XNUMX л воды.4?5H2O, затем налейте около 50 см3 концентрированная аммиачная вода. Добавьте к полученному темно-синему раствору винную кислоту HOOC (HCOH).2СООН до слабокислой реакции (контролируем индикаторной бумагой).
В такой ванне предметы держим дольше (несколько минут). В растворе мы также можем покрыть цинковые предметы медью. Если вы хотите положить крупногабаритный предмет (который не поместится полностью в сосуд), поступайте иначе. Смочить приготовленным раствором ватный тампон или мягкую хлопчатобумажную ткань и протереть всю покрываемую поверхность (помните о защитных перчатках). Через несколько минут тщательно промойте и высушите вещь.
Для химического серебрения готовят смесь из равных массовых количеств: свежеосажденных (отфильтрованных и промытых на фильтре) хлорида серебра AgCl, хлорида натрия NaCl и гидротартрата калия HOOC (HCOH).2COOK (или виннокислый натрий-калий). Мы также можем добавить немного мела, что облегчит полировку поверхности. Составы тщательно растирают в ступке до получения однородной консистенции.
Помните, однако, что приготовление смеси следует проводить в темном помещении (или освещенном только темно-красной лампочкой) и не пользоваться металлическими прутьями, иначе серебряная соль разложится. Полученную таким образом смесь можно хранить в темном сосуде длительное время. Когда мы хотим посеребрить предмет, в порцию смеси добавляем немного воды, обмакиваем тампон в пасту и протираем ею покрываемую поверхность (также в этом случае необходимы защитные перчатки, а кроме того, тщательно закрывая окружающее пространство фольгой, чтобы избежать образования неустранимых черных пятен). Изделие сразу покрывается молочным налетом металлического серебра. Через несколько минут тщательно промойте его, высушите и отполируйте мягкой тканью.
Сегодняшний выпуск был посвящен выводам, вытекающим из положения металлов в ряду напряжений. Поэтому это можно расценивать как диверсию после нескольких последних встреч с камерами. Но в следующем месяце они вернутся со всей своей разрушительной силой, когда мы решим проблемы с коррозией.
Химия в сети
Ряд полезных советов по нанесению гальванических покрытий смотрите на портале по адресу: http://www.galwanizernie.pl/. Химики найдут множество рецептов ванн, позволяющих наносить покрытие химическим способом. Информацию о серебрении и меднении также можно найти на сайтах, посвященных ювелирным изделиям, например. http://www.rynekjubilerski.pl/.
Смещение металла
Металлы можно расположить по возрастанию потенциалов электродов из данного элемента и водного раствора его соли. Такая струна называется электрохимическим (вольтажным) рядом. С увеличением потенциала электрода снижается способность отдавать электроны, в результате чего элемент становится все более сильным окислителем. Практические выводы можно сделать из положения в электрохимическом ряду: ионы данного металла будут отнимать электроны у атомов металла слева (т.е. окислять их до соответствующих катионов), а атомы элемента отдавать от электронов к ионам металлов с правой стороны (они сами окислятся). В просторечии мы говорим о вытеснении металлов из растворов их солей: более активный металл (расположенный слева) вытесняет менее активный (в ряду напряжений, расположенный справа). Следующий эксперимент позволит нам наблюдать эти изменения.
Вам понадобятся три пробирки, наполненные растворами солей серебра (как AgNO3), медь (II) (например, CuSO4 или CuCl2) и свинец (II) (Pb (NO3)2 или (СН3главный операционный директор)2Pb) и образцы металлов? медь, алюминий и цинк (фото 1). Закидываем проволочки или бляшки в пробирки в следующем порядке (фото 2):
— пробирка с ионами Ag+ — медь,
— пробирка с ионами Cu2+ — glin,
— пробирка с ионами Pb2+ — цинк.
Через некоторое время вы можете увидеть признаки происходящей реакции. На поверхности проводов образуются отложения (фото 3), которые лучше видны при крупном плане:
— фото 4: в пробирке с ионами Ag+ на поверхности меди осаждаются серебристые кристаллы металлического серебра, а содержимое сосуда приобретает светло-голубую окраску, которая исходит от гидратированных ионов меди (II);
— фото 5: в пробирке с раствором, содержащим катионы Cu2+ на поверхности алюминиевой проволоки образуется коричнево-красный слой металлической меди;
— фото 6: в трубке с ионами Pb2+ поверхность цинковой пластины покрыта сверкающими кристаллами металлического свинца.
В пробирках происходят следующие реакции:
2Аг+ + медь0 ? 2Аг0? + медь2+
3Cu2+ +2Al0 ? 3Cu0? +2Al3+
Pb2+ + цинк0 ? Pb0? + цинк2+
Реакции вытеснения металла
дерево Дианы
Мы воспользуемся одной из реакций, чтобы провести эксперимент с очень длинной родословной. Их уже разработали алхимики, увлеченные процессами вытеснения металла. Для проведения теста нам понадобится раствор азотнокислого серебра (V) AgNO.3 и медные провода, которые мы сформируем в форме дерева. Размеры котла?завода? подгоним под размеры реакционного сосуда (фото 7). Ставим конструкцию в стакан и заливаем раствором AgNO3 (фото 8). На поверхности медных проводов сразу оседают кристаллы металлического серебра (фото 9 и 10), а при крупном плане видно, что на веточках образуется блестящий?пух? (фото 11). Вытащив его из сосуда (фото 12), можно закрепить нашу работу, например, аккуратно распылив лак (кристаллы серебра слабо связаны с подложкой).
Как уже упоминалось, опыт имеет долгую историю. Сами алхимики назвали получившееся сооружение «деревом Дианы», потому что серебро было посвящено римской богине охоты. Реакция, протекающая в сосуде, представляет собой вытеснение катионов серебра металлической медью:
2Аг+ + медь0 ? 2Аг0? + медь2+
