Неизвестная периодическая таблица, часть 2
После прочтения первой части статьи о загадках таблицы Менделеева таблица Менделеева, описанная в школе с помощью простых правил, вдруг наполнилась исключениями из закономерностей, приведенных в учебниках. Сегодня вы узнаете больше о его секретах. Для этого вы посмотрите на взаимосвязь элементов под другим углом, измените форму таблицы и посчитаете, действительно ли тот или иной элемент находится на своем месте.
Диагональные кузены
вы выяснили, что лишь формально принадлежит к группе 1, о чем свидетельствует, в том числе, тот факт, что фамилия не происходит от его имени (это единственный такой случай в периодической таблице). Однако литий под ним также отличается от остальных собратьев (натрий, калий, рубидий, цезий).
Вы, наверное, знаете, что все распространенные соли натрия i калий хорошо растворяются в воде. Химический анализ идентифицирует ионы металлов по образующемуся ими осадку, а вот с натрием и калием действительно придется потрудиться, чтобы найти такие, которые только плохо растворяются в воде. Аналогично с рубидием и цезием. С другой стороны, литий образует малорастворимые карбонаты, фосфаты или фториды.
Химики пришли к выводу, что такое поведение делает его похожим на элементы группы 2, особенно на магний. У вас не должно возникнуть проблем с проведением экспериментов, подтверждающих предполагаемое сходство. Сульфат или хлорид магний легко доступны, а также карбонат натрия и фосфат. Для фторидов запаситесь солью натрия, калия или аммония. С другой стороны, статья из номера 5/2020 «Юного техника» посвящена литию, где также можно узнать, как получить его соединения в домашних условиях (сырьем являются литиевые элементы (1)).
1. Часто используемый элемент CR2032 — ваш источник лития
Ведущий элемент группы 2 — — больше всего похож на алюминий (в длинной форме таблица Менделеева группа 13 не соседствует со 2, но мы рассматриваем сходство между так называемыми большие группы: 1, 2, 13-18). Оба являются амфотерными металлами, растворимыми в кислотах и основаниях, как и их гидроксиды. Чего нельзя сказать о других бериллиевых обезьянах.
Но не думайте, что литий и бериллий не на своих местах в таблице Менделеева. Оба элемента тесно связаны с остальными членами своих семейств, и некоторая обособленность лидера группы от остальных ее членов является еще одной особенностью таблицы Менделеева. Еще в XNUMX веке химики пришли к выводу, что первый элемент группы обладает свойствами, сходными со свойствами следующего элемента группы, особенно диагонально второго элемента. Они назвали наблюдаемую закономерность правилом диагонального подобия.
Бор, первый элемент в группе 13, также не полностью подобен следующим представителям семейства, например, алюминию. Во-первых, это совсем не металл и он создает очень многое. слабые борные кислоты. При сплавлении оксида бора с оксидами металлов образуются стеклообразные вещества, которые используются в химический анализ (тип металла узнают по цвету так называемой буровой жемчужины). Другие белые грибы так себя не ведут. Однако в группе 14, по диагонали к бору, он лежит. Этот элемент тоже не металл, он тоже создает множество слабые кремниевые кислотыа насчет очков… просто выгляни в окно. Аналогичные сходства можно найти и в других группах, например, кислород по своей реакционной способности подобен хлору.
Преимущества краткой формы
Полная форма преобладает в учебниках и официальных исследованиях. таблица Менделева, первоначально разработанный швейцарским химиком Альфред Вернер, создатель теории сложных отношений. Он четко разбивает элементы на энергетические блоки, но также делает незаметными некоторые аспекты закона периодичности.
Начните с эксперимента. Приготовьте растворы растворимых солей свинца (нитрат Pb (NO3)2 или ацетат (CH3главный операционный директор)2Pb) и барий (хлорид BaCl2 смазать хлыстом Ба(НЕТ3)2). Будьте осторожны, экспериментируя с этими соединениями, поскольку они ядовиты (то есть вы носите защитные перчатки и, конечно же, не едите и не пьете во время работы). Вам также понадобятся растворы хромата калия К.2CrO4 (также токсичен) и растворимый сульфат, например Na2SO4. Реактивируйте соль свинца хроматом и сульфатом и сделайте то же самое с солью бария. Делайте тесты в пробирках или, что лучше, потому что вы экономите реагенты, на полых фарфоровых пластинах, используемых для капельных реакций. Если у вас нет такой пластины, используйте блистер для таблеток или просто смешайте растворы по каплям на фольге.
В случае с масштабом лабораторного эксперимента химики давно стараются быть минималистами, что представляет меньший риск и экономит время и трудозатраты. Независимо от того, как проводились эксперименты, в каждом случае вы получали отложения: белый PbSO4 и BaSO4 и желтый PbCrO4 и светло-желтый BaCrO4 (2). Поведение обоих анионов и формулы образуемых ими солей сходны, можно также добавить, что все они (соли свинца) или до сих пор (соли бария) использовались в качестве пигментов.
i сера это не совпадение, и таких аналогий в таблице Менделеева гораздо больше. Напомним также (выпуск прошлого месяца), что свинец группы 14 охотнее всего принимает валентность, равную II, т. е. такую же, как у слитка группы 2. Кроме того, он часто аналогично реагирует с более тяжелыми щелочноземельными элементами, например, с кальцием, стронцием и барием. на основе образование труднорастворимых сульфатов.
2. Эксперимент, проведенный на фарфоровой пластине (слева) и блистере с таблетками.
(справа — на темном фоне лучше видны светлые отложения).
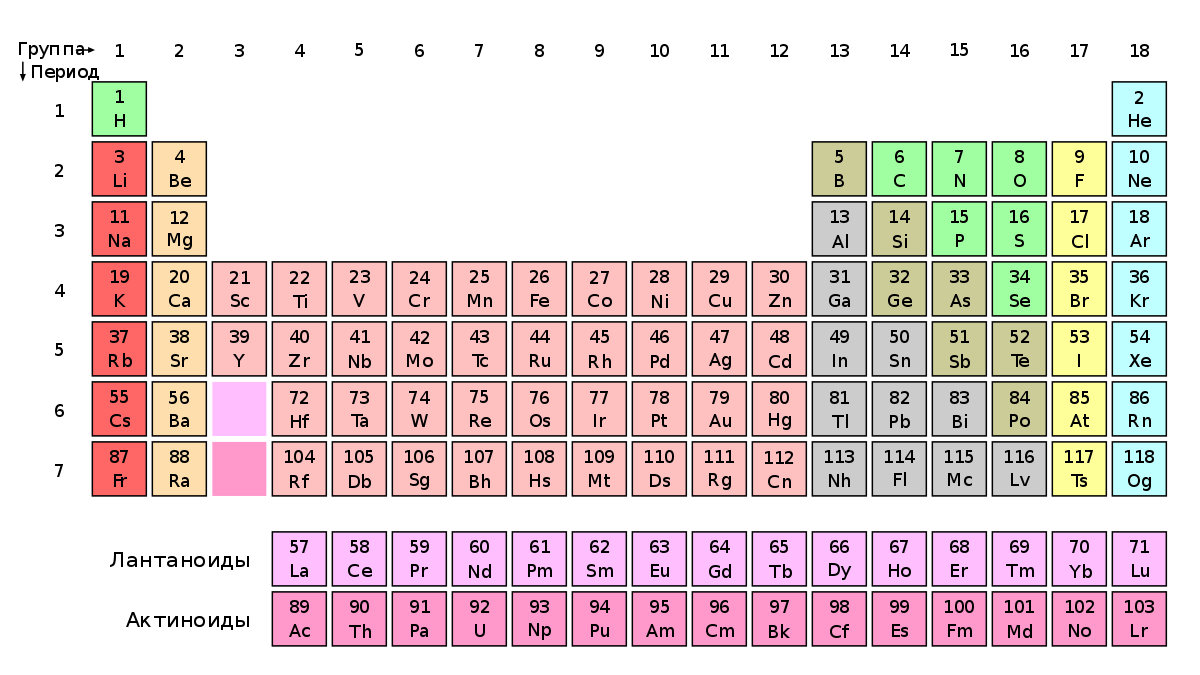
хром она находится в группе 6, а сера — в группе 16. Поэтому они разделены довольно большим расстоянием, но только в длинной форме таблицы. Краткая форма, написанная самим Менделеевым (3), объединяет обе эти группы в одну семью, разделенную на два «рода»: основная группа отмечена символом VIA (группа 16 из полной формы) i боковая группа VIB (группа 6).
То же самое относится и к другим семействам: I группа состоит из группы 1, объединенной с 11, II — из группы 2 и 12 и т. д. Поскольку существует 8 «больших» групп (1, 2, 13—18) и 10 «малых» групп ( 3-12), была проблема с объединением групп 8, 9 и 10 из 18 (во времена Менделеева ее не было, т.к. гелий были обнаружены только в конце 4 века). Химики давно заметили особое сходство свойств между соседними элементами из этих групп, и, таким образом, VIII подгруппа состоит из трех элементов — так называемых триады: черные металлы (Fe, Co, Ni), легкие платиновые группы (Ru, Rh, Pd) и тяжелые платиновые группы (Os, Ir, Pt) (XNUMX). Гелии изначально считались нулевой группой, со временем их отнесли к VIII группе, но, конечно, искать какое-либо сходство благородных газов с другими элементами бессмысленно.
3. Таблица Менделеева в учебнике 1871 г. с пробелами для еще не открытых элементов.
молибден i вольфрам, другие элементы из малой группы VI, как и хром, проявляют сходство с серой и образуют аналогичные соли, например BaMoO4 (молибден) и BaWO4 (вольфрам). также хромий, молибденианы i вольфрамия они легко полимеризуются, создавая кислоты с более сложной структурой. Примером соли такой кислоты является широко распространенный в лабораториях дихромат калия К.2Cr2O7. А сера? Столь же многочисленна группа образуемых им кислот (некоторые не существуют в свободном состоянии, а только в виде солей), примером которых является аналог дихромата — метабисульфат калия К2S2O7. Однако сходство серы с хромами не полное (например, Ag2SO4 растворим в воде, а Ag2CrO4 образует коричнево-красный осадок), это касается только высшей достижимой валентности — VI, на низших аналогия исчезает.
4. Современная форма краткой таблицы Менделеева
Как дела в других группах? Ванадии образуют соли фосфороподобных кислот (H.3PO4, ГПО3), например ванадаты Na3VO4 или НГ4VO3. В группе VII (7 и 17 в длинной форме) аналогия еще яснее. Два популярных соединения калия — надманганский KMnO4 i надхлоран KClO4 — они стали настолько похожими, что образуются даже смешанные кристаллы в любых пропорциях. В этом случае говорят, что соединения проявляют изоморфизм (греч. = одинаковый, = форма), т. е. образуют кристаллы одинакового строения, а размер ионов допускает взаимную замену в кристаллической решетке. Оба соединения также являются окислителями и относительно плохо растворяются в воде (5).
Сходство есть и в других группах: скандалы (группа 3) по свойствам аналогичны алюминию, а титаниды (группа 4) для олова. Цинк i кадм (группа 12) — элементы, реагирующие аналогично магнию (последний, конечно, не амфотерный).
Вы не увидите никакого сходства в группе I. Наименее драгоценные металлы, литий, не имеют никакого отношения к царской семье 11 (медь, серебро и золото). В этом случае вывод из положения в краткой форме таблицы приведет вас к химическому заблуждению.
5. Модели молекул родственных соединений — перхлората (зеленый хлор) и перманата калия (фиолетовый).
Красивый и грозный
В выпуске прошлого месяца вы узнали, что водород лишь формально принадлежит к группе 1, но едва ли какие-либо свойства (кроме валентности) связывают его с основными элементами. В периодическая таблица есть еще один элемент, существенно отличающийся от остальных членов семейства — . С момента своего открытия жидкий металл очаровывал людей, которые еще не подозревали о его смертоносных последствиях.
6. Жидкий металл или благородный газ?
Ртуть относится к 12 группе, в ее случае максимальная валентность II, и такие соединения существуют. Однако серебристая жидкость неохотно делит электроны, о чем свидетельствует ее жидкое состояние и низкая температура кипения. В парообразном состоянии она существует в виде отдельных атомов, а два неактивных электрона на внешней оболочке делают ртуть похожей на… гелий (6). Потеря одного из электронов приводит к тому, что он имеет конфигурацию, подобную водороду, и, подобно водороду, образует двухатомные молекулы — уникальные ионы во всей периодической таблице.
Ртуть тоже, кажется, лежит не на том месте в таблице Менделеева.
